生体/合成高分子のナノ構造・分子認識科学と先端計測法・機能性物質の創成
本研究室では、生体/合成高分子のナノ構造・分子認識科学を利用して新しい先端計測法や機能性物質(検出/診断用分子・薬剤、またこれらを搭載した界面・粒子)を創成する研究を行っています。
1. 核酸が形成するユニークなナノ構造と分子認識
高校の教科書に掲載されている核酸の高次構造は B 型の二重鎖構造 (double-stranded DNA: dsDNA) 、すなわち全ての核酸塩基が水素結合して Watoson-Click 塩基対を形成しています。しかし、核酸の構造は dsDNA だけではありません。RNA や DNA などの核酸には、2 重鎖以外にも 3 重鎖や 4 重鎖構造などの特殊な高次構造もありますし、下図の A ~ I のような 非 Watoson-Clik 塩基対部位というÅ ~ n レベルの構造が分子内に刻まれ、タンパク質を含む各種生体関連分子との相互作用点として機能しています。
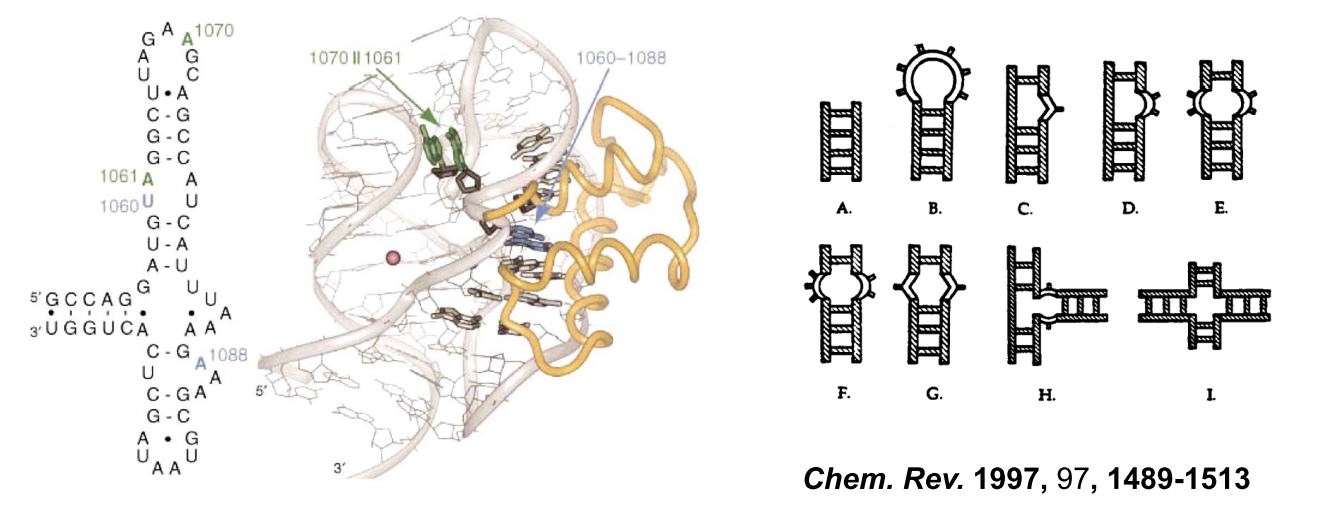
1本鎖 RNA とタンパク質との複合体 (左) と非ワトソンクリック塩基対部位 (右)
A: dsDNA, B: loop, C~D: bulge, E~F: internal loop, G: mismatch base pair, H: three-way junction, I: holiday junction
2. 水素結合による多点相互作用と組み合わせ
一本の水素結合の結合エネルギーは、共有結合の結合エネルギー(数百 kJ/mol)に比べて非常に小さく、一般的には10~40 kJ/mol 程度ですが、多点の水素結合を利用することで熱力学的に安定な結合エネルギーを生体高分子は確保しています。水素結合の数だけでなく、供与体(水素を提供する原子・官能基)と受容体(水素を受け取る原子・官能基)並び・組み合わせも非常に重要です。例えば、下図のように、同じ 3 本の水素結合を介した相互作用であっても、約1000倍も結合親和性が異なることが知られています。静電的相互作用の一種である水素結合は、位置的関係が斜めであっても引力と斥力が発生しており、二次的な水素結合(引力)や静電反発(斥力)が発生するため、水素結合供与体(下図・青色)と受容体(下図・赤色)の並び・組み合わせを変化させることで、相互作用の強さを調節できる仕組みになっています。生体内で様々な大きさの相互作用を利用したい生体にとって、多点水素結合は極めて合理的な相互作用であると言えます。
3. 水素結合性蛍光試薬の分子間相互作用の熱力学的解析と一塩基変異・多型の計測
多点の水素結合は魅力的ですが、水素結合以外にも疎水性相互作は生体関連分子を認識する駆動力として重要です。例えば、過去の我々の研究成果から、脱塩基部位(AP site)に挿入した水素結合性試薬・ナフチリジン誘導体(AND ~ ATMND)の核酸塩基(C:シトシン)に対する結合親和性が、分子内のメチル基の数が多くなるほど疎水性相互作用が増大することが明らかになっています(NAR 2009, 下・Table 1 の TΔS の変化を参照)。また、ナフチリジン誘導体の蛍光応答を利用することで、AP site の向かい側にあるひとつの核酸塩基を目視判定する計測技術の開発に成功しています。これは遺伝子配列中のポイントミューテーションや、一塩基多型(SNPs)の簡易判定法として応用可能です(JACS 2003)。当研究室では、保有する ITC や SPR を用いてリガンドと標的分子間の相互作用の熱力学的な解析を “平衡論”・”速度論”的に実施します。

4. 分子認識能をもつ 1 本鎖核酸 “核酸アプタマー”
分子認識能をもつ 1 本鎖核酸のことを “核酸アプタマー” と呼びます。核酸が形成する熱力学的に安定な非 Watoson-Clik 塩基対部位が結合モチーフとなり、標的分子と相互作用することができます。下の画像で赤色で示す分子は、当研究室で独自に確立した MACE-SELEX 法と呼ばれる核酸アプタマースクリーニング法(MACE-SELEX, 後述)を使って発見した Thrombin-binding DNA Aptamer (M08s-1, 後述) の結晶構造 (PDB ID: 8BW5)です。一本鎖 DNA (ssDNA) が折り畳むことで形成された分子内四重鎖構造が、血液凝固因子である Thrombin の Exosite I と結合し、血液の凝固作用を阻害する薬剤(抗凝固剤・抗血栓剤)として機能します。水素結合、疎水性相互作用、ファンデルワールス力、静電的相互作用、などが絶妙に絡み合うことで、核酸アプタマーの特異的な分子間相互作用が発現します。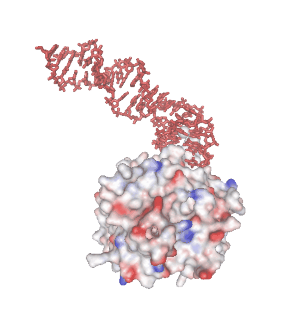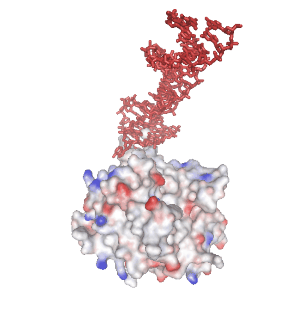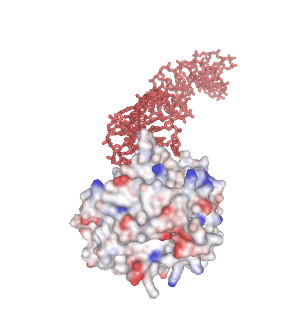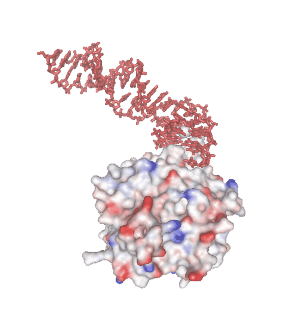
5. 核酸アプタマーを獲得する分子進化工学的手法 “SELEX”
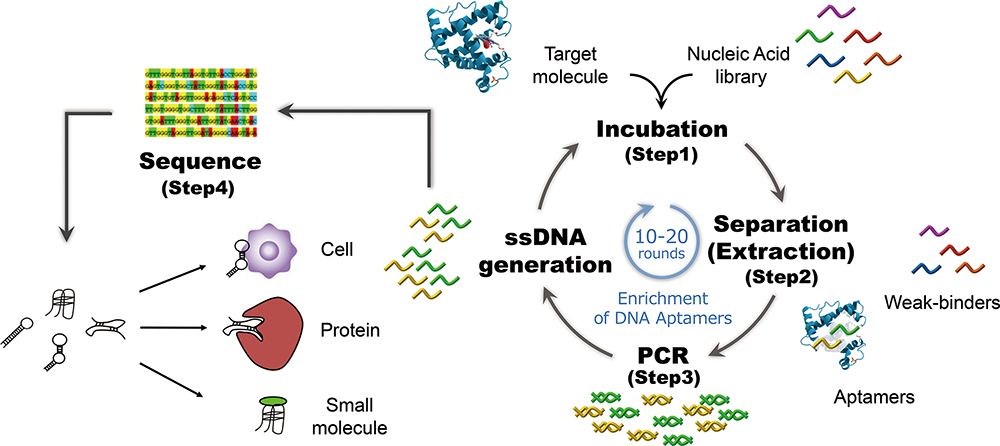
自然界の進化の工程を模倣し、標的分子に対して結合親和性をもつ分子のを獲得する手法を分子進化工学と呼びます。核酸アプタマーを取得するための分子進化工学的手法は SELEX(Systematic Evolution of Ligands by EXponential enrichment)と呼ばれ、1990年代に発案されました。下は、自然界の進化の工程を示しており、自然界と SELEX の工程における選択圧と淘汰・濃縮物を比較した図になります。

SELEX 法の実験的なスキームを下に示します。従来型の SELEX では、Incubation から ssDNA generation までを 1 サイクルとする工程を約十数回繰り返す必要がある上に、成功確率が低い、成功しても1~2配列しか獲得できない、等の課題がありました。SELEX の課題の原因は、標的分子などに対する非特異的な結合や非結合性配列の PCR 増幅工程 (下図 step 3) へのコンタミネーションにあると我々は考えました。
6. キャピラリー電気泳動(CE)内の”非平衡”環境を利用する分子分離技術 “MACE” と SELEX 法への導入
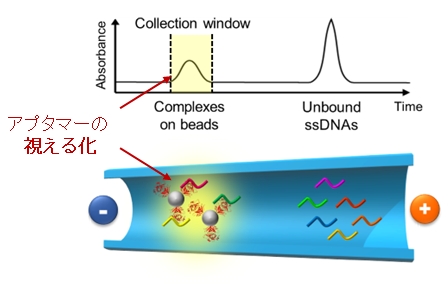
我々は、微粒子導入型キャピラリー電気泳動(MACE)という新しい分子分離技術を SELEX の Step 2 に工程に導入した MACE-SELEX 法を独自に開発しました(特許 WO2017-126646)。キャピラリー電気泳動(CE)は、キャピラリー内の溶液中で分子や複合体を電圧を用いて分離する手法で(下図参照)、分離過程で複合体に非平衡環境を付与、すなわち、解離方向への推進力を与えることで、弱い結合や非結合性の分子を標的分子から効率良くふるい落とすことが可能です。

通常の CE では標的分子はラベル化せずに注入・検出します。一方 MACE は磁性粒子上に標的分子を固定化して注入・検出します。磁性粒子上に標的分子を固定化することで、本来 CE では検出できなかった低濃度の標的をモニタリング(視える化)することができます。下図は MACE の概略図で、標的分子を固定化した磁性粒子とDNAライブラリーの混合溶液を CE 内で分離した図になります。分離後の複合体周囲はリガンドである核酸の濃度が低下しており、解離方向への強い推進力が働きます。その結果、効果的に磁性粒子に固定化した標的分子(Complex on beads)から非結合性の配列(Unbound ssDNAs)を振るい落とす・分離することができます。我々のグループでは、MACE-SELEX 法を用いることで様々な標的分子に対する DNA アプタマーを 3 サイクル程度で獲得し、一度の MACE-SELEX で約10配列程度の行為捕配列を獲得できるようになりました(MTNA 2019, ChemBioChem 2021, Anal. Chem. 2022)。
本研究室では、上記技術の獲得により様々な分子に対する核酸アプタマーの獲得ができるようになりました。本研究室では、タンパク質や他の生体関連分子に加え、核酸アプタマーを絡めた分子認識科学を理解・活用することで新しい先端計測法や機能性物質(検出/診断用分子・薬剤やこれを搭載した界面・粒子)を創成する研究を行っています。
以下は、核酸アプタマー薬に関する研究パートにフォーカスした研究紹介です。
新しい薬剤分子のモダリティ”核酸医薬品”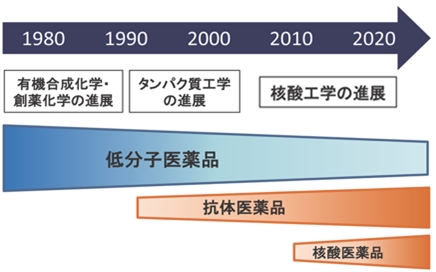
1980年~1990年頃の有機合成化学の進展は多くの低分子医薬品を我々にもたらしました。また、1990~2000年頃のタンパク質工学の進展は、組み換えタンパク質や抗体などのバイオ医薬品を誕生させました。さらに近年、核酸の固相合成技術、さらに塩基配列解析技術に大きな進展があり、核酸分子を薬剤として利用する新しい薬剤モダリティ(薬剤分子の種類)の波が到来しています。当研究では、他のモダリティにはない核酸の特長を活かした分子認識型核酸 “核酸アプタマー” を利用する創薬、計測科学、バイオマテリアルに関する研究を行っています。
次世代の中分子分子標的薬 “核酸アプタマー”
核酸アプタマーは、分子認識能をもつ核酸塩基配列のことで、中分子型の分子標的薬に分類されます。下は加齢黄斑変性症に対する核酸アプタマー製剤の例で、眼球裏にある血管の異常増殖を抑制する分子標的薬です。異常増殖した血管が眼球を圧迫することで、視野に異常をきたす病気の治療薬として利用されています(正体は VEGF-A に結合する化学修飾された RNA アプタマーです)。
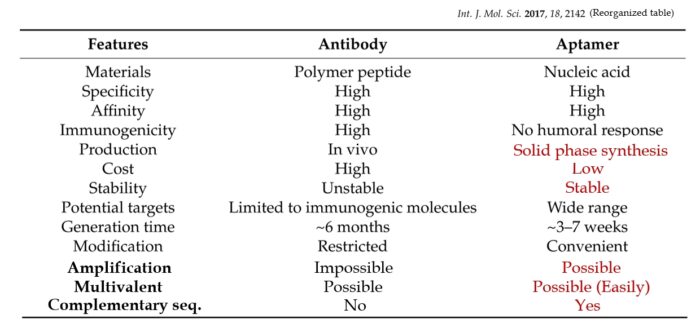
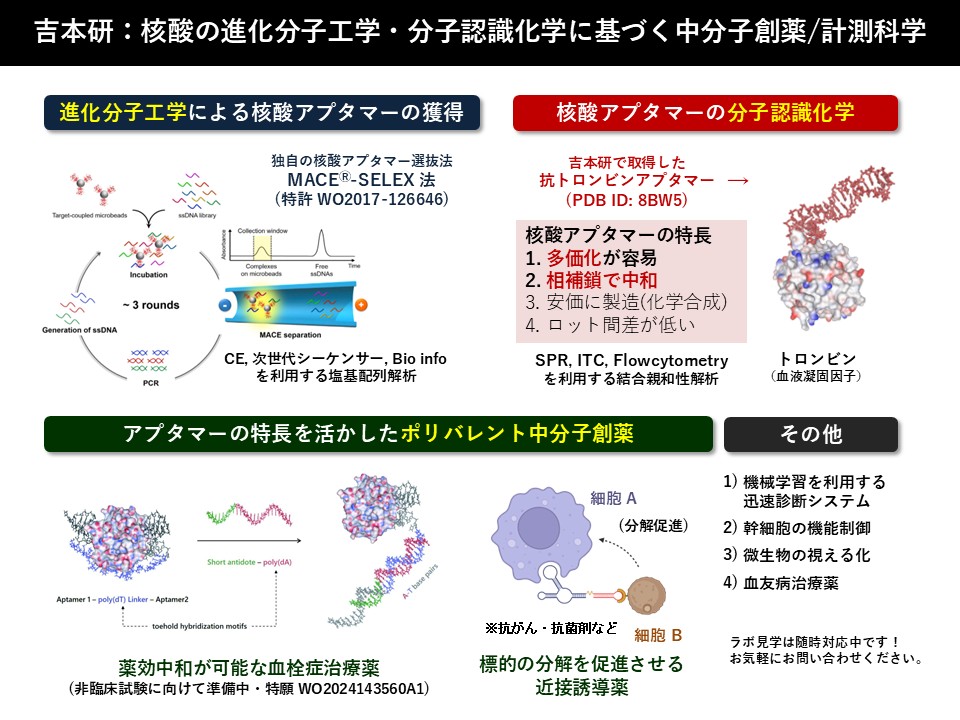
核酸アプタマーの特長を、他の医薬品である”低分子”と”抗体”と比較した表とともに下に記載しました (表は吉本が作成したものです。参考程度にお読みください。また、転載・転用などは禁止します)。核酸アプタマーの特長を端的に説明すると、安くて、品質が一定で、薬効が高く、相補鎖で薬効を簡単に中和することができる点にあります。さらに、複数のアプタマーを繋げたものを容易に設計し(多価化)、迅速に入手することができます。特に、「相補鎖で中和可能」と「多価化が容易」は、他のモダリティーにはない核酸アプタマー独特の特長です。
吉本研では、核酸アプタマーを効率良く獲得する分子進化工学的手法 MACE®-SELEX 法(後述)の構築に成功しており、獲得した核酸アプタマーを薬剤分子や検出用分子としてに関する研究を行っています。これまでの研究の成果の一部を下に紹介します。
研究成果 (1): 薬効中和可能な血液凝固阻害薬としてのバイスペシフィックアプタマー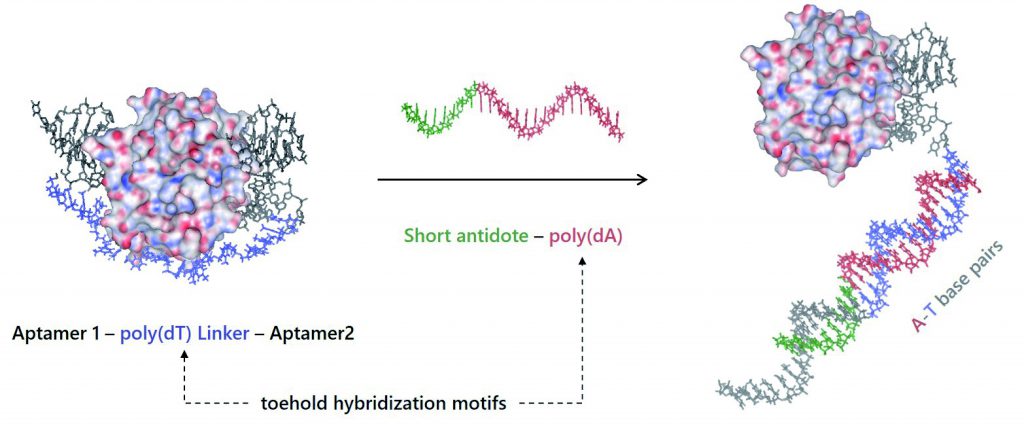
上図に示すように、血液凝固因子であるトロンビンという酵素に結合する DNA アプタマー二種類をリンカーで連結した、二重特異性DNAアプタマー(バイスペシフィックアプタマー)を設計し、In vitro の薬理活性試験を行ったところ、過去最高の抗血液凝固能を示すDNAアプタマーの構築に成功しました。
上図左は、アプタマー2量体とトロンビンとの複合体の、分子モデリングの結果です。上述したように、核酸アプタマーの特長の一つは「相補鎖で中和可能」になります。87塩基からなるバイスペシフィックアプタマーをトロンビンから剥ぎ取り、薬理活性を中和する一本鎖 DNA の設計と評価を行いました。その結果、完全相補鎖な87塩基の一本鎖 DNA (ssDNA) よりも、37 塩基の短いssDNA の方が中和剤としての性能が高いという興味深い結果が得られました。バイスペシフィックアプタマーの薬効を効率よく中和するための重要な要素として、(1) バイスペシフィックアプタマーのリンカー(上図 紫色)と相補鎖を形成する配列(上図 赤色)の存在と、(2) Exocite I アプタマー(上図 Aptamer 1 側)の塩基配列の半分と相補鎖を形成する短い配列(上図 緑色)が重要であることが明らかとなりました。
中和剤の分子量を小さくなると総投与質量が小さくなるため、得られた分子設計指針を活用することで、中和剤による副作用を大幅に低減することができます(RPTH 2021 にて発表済)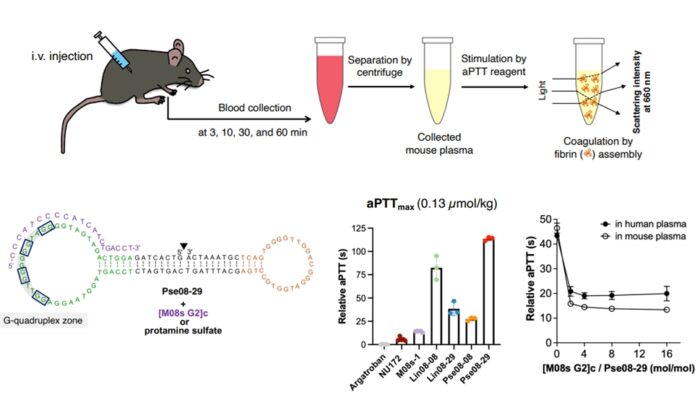 現在までに、共同研究グループである奈良県立医大の研究チームと動物実験を行い、上図に示す Pse08-29 というバイスペシフィックアプタマーが生体内において最も有望なバイスペシフィックアプタマーであることを明らかとしています。詳細については以下の2023年のプレスリリースなどを参照ください。
現在までに、共同研究グループである奈良県立医大の研究チームと動物実験を行い、上図に示す Pse08-29 というバイスペシフィックアプタマーが生体内において最も有望なバイスペシフィックアプタマーであることを明らかとしています。詳細については以下の2023年のプレスリリースなどを参照ください。
➡解説:東京大学 PRESS RELEASES (0808 Japanese/ 08/29 English)
➡解説:東京大学 大学院総合文化研究科・ニュース 2023 08/08
➡解説:EurekAlert! 08/29, AlphaGalileo 08/29
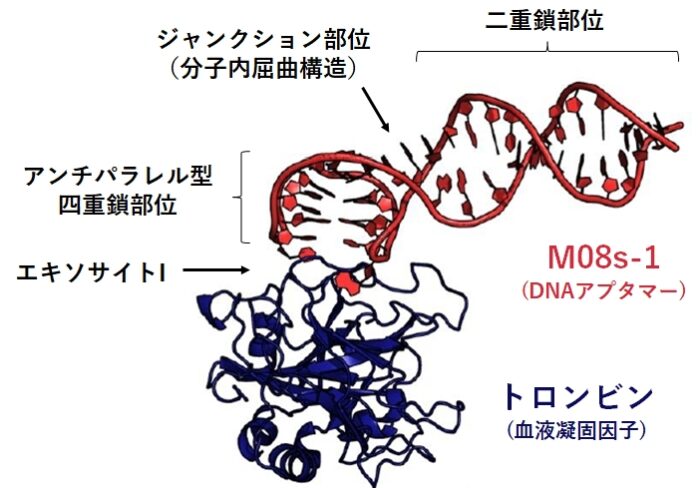
研究成果(1)で紹介したトロンビンに結合するバイスペシフィックアプタマーは、上記MACE®-SELEX法で獲得したDNAアプタマーで、 M08 という名称のものです(下の構造)。トロンビンに結合するアプタマーは HD1 や NU172 RE31などが既に発見されていましたが、我々が獲得した M08 および M08s-1 は、HD1などの過去のアプタマーと同程度の結合親和性であるにもかかわらず、高い薬理活性を示すことがわかっていましたが、その理由については不明なままでした。
イタリアのナポリ大学との共同研究の結果、M08s-1の結晶構造が明らかとなり、M08s-1の分子内屈曲構造が高い薬理活性の原因であることがわかりました。上の赤い核酸分子は四重鎖構造と二重鎖構造を併せもち、接合部分が屈曲しているというユニークな高次構造を形成しています。詳細については下の2023年のプレスリリースなどを参照ください。
➡解説:東京大学 PRESS RELEASES 2023 08/01
➡解説:東京大学 大学院総合文化研究科・ニュース 2023 08/02
➡Protein Data Bank: 8BW5
産業界における核酸アプタマーの利用を活性化することを目的とした LinkBIO という会社をスタートさせ、MACE-SELEX法の社会実装に挑戦しています。DNAアプタマーの探索事業を行っているのでご興味のある方はいつでもコンタクトください。
研究成果 (3): 人工サイトカインを模倣して血管新生を促進するアプタマー
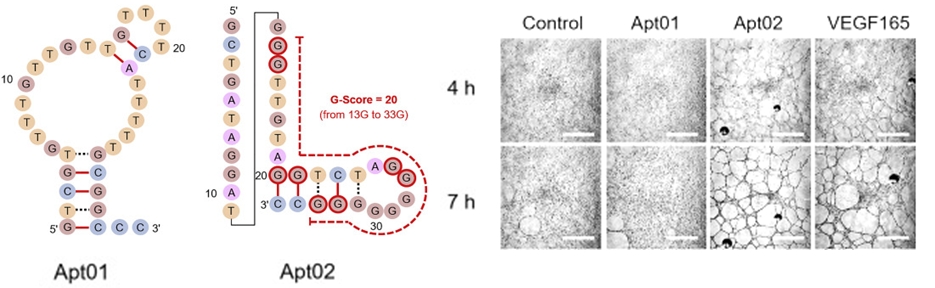
核酸アプタマーは、研究成果1 のような結合阻害剤ではなく、サイトカインである液性タンパク質のように、生体イベントにスイッチを入れられる分子として利用することもできます。VEFG-A を含む VEGF ファミリータンパク質は、細胞表面上にある受容体と結合することで血管内皮細胞から血管が形成される現象(血管新生)を促進させることが知られています。我々の研究室では、VEGF-R1 と VEGF-R2 の両方に結合する複数の DNA アプタマー(上図左)の獲得に成功し、Apt 02 が VEGF-165 (≒ VAGF-A) と同じように血管新生を促進させる非常に珍しい分子であることを発見しました(上図右)。
サイトカインの多くは常温における長期保存が難しく、常温での長期保存に全く問題のない核酸アプタマーをサイトカインの代用(人工サイトカイン)として利用する事は、大きな意義とメリットがあります(MTNA 2020 にて発表済)。
研究成果 (4): 核酸アプタマーを利用する高感度抗がん剤検出システムの開発
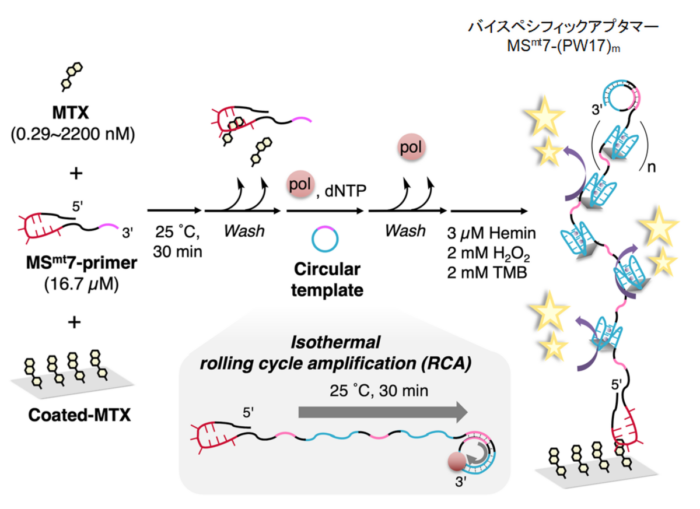 メトトレキサート(MTX)は、白血病やリンパ腫などのさまざまな癌の治療に使用される低分子型の資料薬ですが、MTXの血中濃度が高いと副作用のリスクがあるため、血中のMTX濃度を注意深く監視することが不可欠です。現在、MTX濃度は臨床現場で抗体ベースのキットを使用して測定されていますが、いくつか問題点があります(こちらを参照)。我々の研究グループは、化学的に合成可能な DNA を用いるMTX検出システムを開発しました。独自に獲得したDNAアプタマーは、抗MTX抗体と同程度の特異性を有し、ペルオキシダーゼ活性をもつもうひとつのDNAアプタマー(DNAzyme)と連結させることで検出用のバイスペシフィックアプタマーを構築しました。ローリングサークル増幅でDNAzyme領域を増幅すると、検出限界が290pMの高感度な検出が可能となりました。DNAベースのMTX検出システムは、実験室および診療所で抗体に依存しないMTX検出を提供できます(Anal. Chem. 2022)。下記のニュースも参照ください。
メトトレキサート(MTX)は、白血病やリンパ腫などのさまざまな癌の治療に使用される低分子型の資料薬ですが、MTXの血中濃度が高いと副作用のリスクがあるため、血中のMTX濃度を注意深く監視することが不可欠です。現在、MTX濃度は臨床現場で抗体ベースのキットを使用して測定されていますが、いくつか問題点があります(こちらを参照)。我々の研究グループは、化学的に合成可能な DNA を用いるMTX検出システムを開発しました。独自に獲得したDNAアプタマーは、抗MTX抗体と同程度の特異性を有し、ペルオキシダーゼ活性をもつもうひとつのDNAアプタマー(DNAzyme)と連結させることで検出用のバイスペシフィックアプタマーを構築しました。ローリングサークル増幅でDNAzyme領域を増幅すると、検出限界が290pMの高感度な検出が可能となりました。DNAベースのMTX検出システムは、実験室および診療所で抗体に依存しないMTX検出を提供できます(Anal. Chem. 2022)。下記のニュースも参照ください。
➡ 解説:東京大学 大学院総合文化研究科・ニュース 2023 01/23
その他の研究
以下に、過去に行った研究テーマを記載します。
3D培養法や機能性培養皿を利用する幹細胞の分化制御
ACS Appl. Bio Mater., 1 (3), 538-543 (2018)
ACS Appl. Mater. Inter., 9 (11), 9339-9347 (2017).
CRISPER-Cas9 を用いる幹細胞の内在性遺伝子の発現操作
ACS Synth. Biol., 6 (12), 2191–2197 (2017).
Nat. Methods, 14, 963-966 (2017).
細胞の低侵襲な分離/濃縮用電極デバイス
Analytical Sciences, 35(8), 895-901 (2019).
Sensors, 18(9), 3007 (8 pages) (2018).
藻類細胞に対するバイオマテリアルの提案
ポリマーゲル封入培養法による藻類細胞の多細胞化
Plant and Cell Physiology, 61(1), 158-168 (2020).
藻類細胞が生産するバイオ燃料や薬剤生産量の上方制御
Journal of Bioscience and Bioengineering, 128(6), 751-754 (2019).
藻類細胞への高効率な遺伝子導入法の開発
Science and Technology of Advanced Materials, 22(1), 864-874 (2021).
など。ラボには核酸アプタマーの評価用装置に加え、細胞培養設備(クリーンベンチや蛍光顕微鏡)などもあります。